最新!3月重点医药政策盘点
一、本月国家部委发文政策收集统计
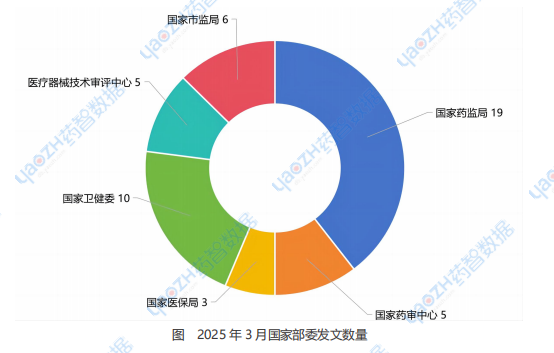
2025年3月,药智网收集的国家药监局发文政策19条;国家药审中心发文政策5条;国家医保局发文政策3条;国家卫健委发文政策10条;医疗器械技术审评中心发文政策5条;国家市场监督管理局发文政策6条。
二、本月医药政策速览
药品类
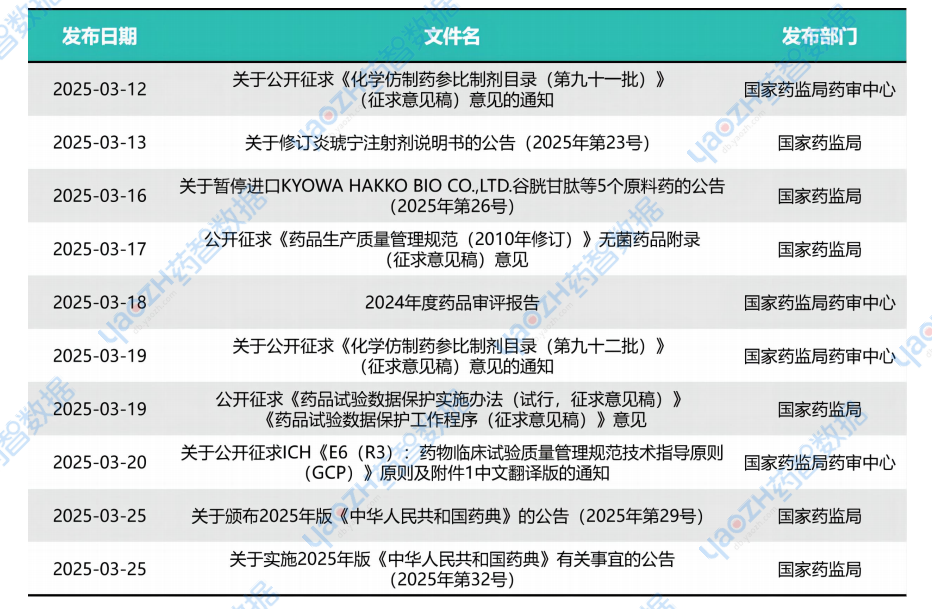
数据来源:药智数据-政策法规数据库
医疗器械类

数据来源:药智数据-政策法规数据库
其他类

数据来源:药智数据-政策法规数据库
药品类重点法规梳理:
1. 国家药监局综合司公开征求《药品生产质量管理规范(2010年修订)》无菌药品附录(征求意见稿)意见
国家药监局近期发布的《药品生产质量管理规范(2010年修订)》无菌药品附录(征求意见稿)对现行规范进行了全面修订,旨在提升无菌药品生产的质量安全水平,并与国际标准接轨。以下是相较于现行版本(2011年版)的主要变化点:
(1)条款与术语全面扩充
条款增量:由81条跃升至235条,细化要求更精准。
术语拓展:从6个增至33个,新增“细菌截留试验”等关键术语。
(2)适用范围进一步拓宽
明确将无菌辅料及直接接触药品的无菌包装材料生产纳入规范。
(3)污染控制策略(CCS)全新引入
要求企业建立涵盖多方面的CCS,并定期审核更新,确保污染预防效果。
(4)洁净区与设施标准升级
分级细化:明确A级至D级洁净区风险等级。
技术革新:鼓励使用隔离器、RABS等先进技术,减少人为干预。
气流研究:A级区需进行静态和动态气流深入研究。
(5)人员管理力度加强
A/B级区人员需定期无菌更衣确认及气流可视化培训。
减少洁净区人员数量,规范操作行为,确保环境稳定。
(6)生产与灭菌管理细化升级
灭菌工艺优先:首选最终灭菌,必要时采用除菌过滤并验证完整性。
技术管理细化:明确FFS、BFS等特定技术要求。
无菌工艺模拟:模拟最差条件,验证无菌工艺有效性。
(7)质量控制与监测全面强化
环境监测数据成为批次放行重要依据。
鼓励采用已验证的自动化微生物检测方法。
无菌检查结合环境监测数据,确保产品安全。
(8)包装容器密封性要求优化
熔封产品根据容量制定不同测试标准。
非熔封产品需基于风险评估制定抽样计划。
(9)5.0μm粒子标准调整
A级区不再强制要求静态和动态监测5.0μm粒子,适应新标准。
(10)与国际标准接轨
参考欧盟GMP附录1(2022版),引入CCS、PUPSIT等国际概念,推动规范国际化。
2. 国家药监局综合司公开征求《药品试验数据保护实施办法(试行,征求意见稿)》《药品试验数据保护工作程序(征求意见稿)》意见

图片来源:NMPA官网
《药品试验数据保护实施办法(试行,征求意见稿)》和《药品试验数据保护工作程序(征求意见稿)》的出台,标志着我国药品试验数据保护制度的正式建立,这一制度的建立,将为医药创新提供更加有力的法律保障,促进医药行业的高质量发展。以下是两份征求意见稿的核心内容、创新点、实施机制及政策意义。
(1)核心内容
保护对象:创新药、改良型新药、仿制药分类保护,覆盖化药和生物药。
保护期限:
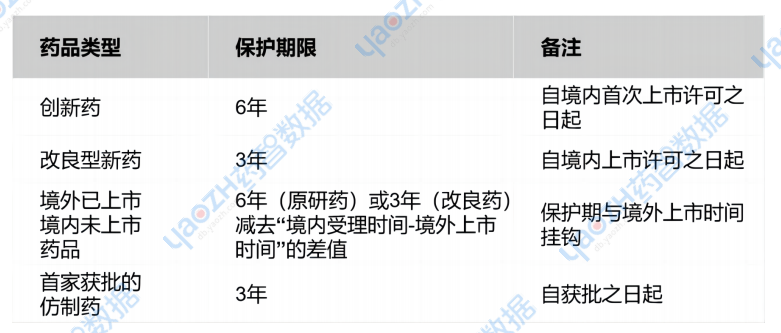
保护范围:安全性、有效性、质量数据(不含BE/免疫原性数据)。
(2)政策亮点
覆盖生物药:CAR-T、单抗等纳入保护。
适应症独立保护:同一药品不同适应症可分别申请。
鼓励全球同步:境外药品在华保护期与海外上市时间挂钩。
数据资产化:允许原研企业授权仿制药企使用数据。
(3)实施机制
申请公示:上市申请时同步提交,CDE公示保护信息。
保护期限制:仿制药企未经许可依赖原研药受保护数据者不予批准。
终止情形:药品撤销或持有人放弃时保护终止。
(4)政策意义
激励创新:数据独占弥补专利保护不足。
仿制平衡:允许保护期结束前1年提交仿制申请。
国际对标:参考美欧数据保护模式,符合WTO规则。
3. 国家药监局 国家卫生健康委关于颁布2025年版《中华人民共和国药典》的公告(2025年第29号)、国家药监局关于实施2025年版《中华人民共和国药典》有关事宜的公告(2025年第32号)
图片来源:NMPA官网
2025年版《中华人民共和国药典》(以下简称《中国药典》),以及药典实施有关事宜的公告已由国家药监局、卫健委颁布,自2025年10月1日起实施。
声明:本文观点仅代表作者本人,不代表本网站立场,欢迎在留言区交流补充;如需转载,请务必注明文章作者和来源。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间处理。



 江西仁和中方医药股份有限公司
All Rights Reserved
江西仁和中方医药股份有限公司
All Rights Reserved